باتریها انواع گوناگونی دارند. باتری خشک، باتری نیکل کادمیوم (Ni-Cd)، باتری نیکل متال هایدرید (Ni-MH)، باتری لیتیوم (Li)، باتری اسیدی، سلولهای الکترو شیمیایی و باتری خورشیدی از انواع باتریها هستند. کاربرد باتریها برای فعّال کردن مدار است (یعنی روشن کردن و به کار افتادن مدار)، به طوری که تمام مدارهایی که با باتری کار میکنند، بدون باتری باید دور انداخته شوند (مثل ساعت، تلفن همراه و…).
نکته: منظور از شارژ باتری، پر شدن باتری و منظور از دشارژ باتری، خالی شدن باتری میباشد.
انواع باتری
۱) باتریهای خشک یا الکالاین (Alkaline)
این نوع باتریها قابل شارژ نیستند. یکی از پر کاربردترین نوع باتریها هستند و انواع گوناگونی دارند. باتریهای لکلانشه و بعضی از باتریهای قلیایی از انواع باتری خشک محسوب میشوند. باتری قلمی معروفترین نوع این باتریها است که در اکثر وسایل الکترونیکی از قبیل: ساعت دیواری، کنترل تلویزیون و… بکار میرود. باتریهای خشک معمولاً برای مدارهایی که جریان کمی مصرف میکنند و ایده آل هستند.
قطب مثبت در باتریهای خشک لکلانشه یک میلهی گرافیتی در مرکز باتری است و قطب منفی آن، لایهی نازکی از فلز روی در اطراف باتری است که معمولاً زیر پوششی از پلاستیک و یک لایهی حلبی قرار دارد و تا هنگامی که قطب منفی باتری (که همان فلز روی است)، خورده نشود، از باتری میتوان جریان کشید و وقتی که قطب منفی باتری کاملاً از بین رفت، باتری کار نمیکند.
نکته: با تعویض فلز روی در اطراف باتری، میتوان باتری را دوباره استفاده کرد، ولی معمولاً کسی این کار را انجام نمیدهد.
اگر جریان زیادی از باتری خشک کشیده شود، به سرعت دشارژ میشود و ولتاژ باتری شروع به کم شدن میکند در این صورت عمر مفید باتری کاهش مییابد.
نکته: علت این کاهش ولتاژ این است که در درون باتری و در اطراف کاتد (قطب مثبت) و آند (قطب منفی) گازهایی مانند هیدروژن (H۲) و آمونیاک (NH۳) تولید میشود که لایهای عایق در داخل باتری ایجاد میکنند و مانع از عبور جریان میشوند.
نکته: یکی از معایب باتریهای لکلانشه، تولید گازهایی در داخل باتری و وقوع واکنشهای نا خواسته است.
در
باتریهای قلیایی هیچ واکنش نا خواستهای در داخل باتری رخ نمیدهد به
همین دلیل میتوان از این باتریها برای مدت بیشتری استفاده کرد.
قطب
مثبت در این باتریها مخلوطی از گرافیت (C) و اکسید منگنز (MnO۲) است که در
اطراف باتری و زیر پوششی یک لایهی پلاستیکی و یک لایهی حلبی قرار دارد و
قطب منفی این نوع باتری یک میلهی برنجی در وسط باتری است که با خورده شدن
آن باتری از کار میافتد.
نکته: در همهی باتری ها، تا هنگامی که قطب منفی باتری خورده نشود، باتری کار میکند.
۲) باتری نیکل کادمیوم (Ni-Cd)

نوعی از باتریهای قابل شارژ هستند که قیمت بالاتری نسبت به باتریهای خشک دارند. این نوع باتریها در شکل ها، اندازهها و ولتاژهای گوناگونی ساخته میشوند. این نوع باتریها در وسایلی کاربرد دارند که دائماً استفاده میشوند، زیرا این باتریها باید حداقل هفتهای یک بار شارژ کامل و دشارژ کامل شوند، زیرا در غیر این صورت روزانه ۱% از توان آنها کم میشود و در صورتی که این باتریها برای چند روز در حالت شارژ بمانند، آسیب میبینند. نوع قلمی این باتری ولتاژ ۱/۲۵V تولید میکند.
جریان دهی باتریهای نیکل کادمیوم را با میلی آمپر ساعت (mAh) مشخص میکنند و جریان دهی بیشتر باتریهای نیکل کادمیوم بین ۵۰۰mAh تا ۱۰۰۰mAh میباشد. آمپر ساعت به این معنا است که یک باتری در یک ساعت چقدر جریان میتواند به مدار بدهد؛ مثلاً اگر جریان دهی یک باتری ۵۰۰mAh باشد، به این معناست که آن باتری میتواند در یک ساعت ۵۰۰mA جریان به مدار بدهد و اگر در یک ساعت از این مقدار جریان بیشتری از باتری کشیده شود، در این صورت ولتاژ باتری رو به کاهش میگذارد و در یک ثانیه میتوان جریان ۵۰۰mAh÷۶۰min=۸/۳۴mA از این باتری کشید که جریان بسیار کمی است، ولی بعضی از باتریهای نیکل کادمیوم بزرگ میتوانند تا ۱۴/۴Ah جریان تولید کنند (در هر ثانیه ۲۴۰mA).
۳) باتری نیکل متال هیبرید (Ni-MH)

این نوع باتری (nickel-metal hybride) جریان دهی بیشتری نسبت به باتری نیکل کادمیوم دارد. مثلاً نوع قلمی باتری نیکل کادمیوم تا حدود ۱۲۰۰mAh جریان تولید میکند، ولی نوع قلمی باتری Ni-MH تا حدود ۴۸۰۰mAh جریان تولید میکند!
هشدار خیلی مهم:
کادمیوم یک فلز بسیار سمّی است. هرگز باتریهای Ni-Cd و Ni-MH را اتصال کوتاه نکنید، چون ممکن است آسیب ببینند (چون هنگام اتصال کوتاه کردن این باتریها جریان بسیار زیادی از باتری کشیده میشود. عبور این جریان زیاد از باتری میتواند به باتری آسیب برساند و باعث گرم شدن باتری میشود).
۴) باتری لیتیوم (Li)
باتری لیتیوم در دو نوع قابل شارژ و غیر قابل شارژ وجود دارد. نوع غیر قابل شارژ این باتری که به آن باتری لیتیوم میگویند، عمر طولانی دارد و خیلی کم دشارژ میشود بنابراین از آن در ساعت مچی، باتری ماشین حساب و وسایل مشابه استفاده میکنند. باتری لیتیوم نمونهای از باتریهای قلیایی است. اگر بر روی یک باتری کلمهی Li درج شده باشد به این معناست که آن باتری، باتری لیتیوم خشک (غیر قابل شارژ) میباشد.
نوع قابل شارژ باتری لیتیوم نیز دو نوع هستند:
الف) لیتیوم-یون (Li-ion):
باتری Li-ion در تلفنهای همراه، لپ تاپها و وسایل مشابه استفاده میشود، چون این وسایل دائماً در حال استفاده هستند. این باتریها بسیار حساس میباشند و با کوچکترین تغییرات ناگهانیای مانند افزایش و یا کاهش دما و یا کشیده شدن جریان بیش از حد، منفجر میشوند! (در بعضی از لپ تاپها این اتفاق رخ داده است!). تا هنگامی که صفحات داخلی این نوع باتری خورده نشود، میتوان این باتری را مورد استفاده قرار داد و آن را شارژ کرد.
ب) پولیمر لیتیوم ـ. یون (Li-polymer):
باتریهای پولیمر لیتیم ـ. یون که گاهی به Li-Poly یا Lipo نیز مشهورند، اساسا شبیه به باتریهای لیتیم ـ. یون هستند. اختلاف اصلی در آن است که پولیمرهای لیتیم ـ. یون بسیار نازکتر هستند، با اندازههایی به کوچکی یک میلیمتر. باتریهای پولیمر لیتیم ـ. یون بسیار سبک نیز هستند و در برابر شارژ بیش از حد و نشت مواد شیمیایی نیز مقاومترند. اما تولید آنها گرانتر از باتریهای لیتیم ـ. یون تمام میشود و چگالی انرژی پایین تری دارند. باتریهای پولیمر لیتیم ـ. یون بیشتر دروسایل الکترونیکی سبک وزن و گران قیمت مانند گوشیهای موبایل به کار میروند.
خطر کدامیک بیشتر است؟لیتیوم پلیمر یا یون+ویدیو
۵) باتریهای اسیدی(lead–acid):

همانطور که از نام این باتریها پیداست، این باتریها از صفحات فلزی و اکسید فلزی ساخته شده اند که این صفحات در محلولی از اسید ضعیف و آب قرار دارند. باتری اتومبیل و باتری موتور نمونههایی از این باتریها هستند. باتریهای اسیدی قابل شارژ میباشند و میتوان آنها را شارژ کرد. روش شارژ همهی باتریهای قابل شارژ از جمله باتریهای اسیدی بعداً گفته خواهد شد.
باتری خودرو:

باتری خودرو نوعی باتری سربی-اسیدی است که از صفحات نازک سرب و اکسید سرب IV تشکیل شده است که این صفحات با فاصلهی کمی از هم در داخل محلول رقیقی از اسید سولفوریک (H۲SO۴) قرار دارند و این مجموعه در درون محفظهی پلاستیکی واقع شده است که به این محفظهی پلاستیکی، سلول میگویند.
باتری اتومبیل از به هم بسته شدن ۶ سلول به وجود میآید که هرکدام از این سلولها ۲V برق تولید میکنند و در مجموع ۱۲V برق توسط این سلولها تولید میشود. در هر سلول کاتد (قطب منفی باتری) فلز سرب است و آند (قطب مثبت باتری) سرب IV اکسید است. وقتی از باتری جریان کشیده میشود، کاتد شروع به خورده شدن توسط اسید میکند و به سولفات سرب که به صورت گرد سفید رنگی است، در اطراف الکترودها (کاتد و آند) تجمع پیدا میکند تا هنگامی که این گرد سفید مانع از خورده شدن کاتد بشود، ولتاژ سلول شروع به کاهش میکند (با خورده شدن کامل آند هم این اتفاق تکرار میشود) و در این صورت باید باتری را شارژ کرد به این صورت که یک ولتاژ خارجی در حد ۱۳V باید به باتری اعمال کرد تا مجدداً آن گرد سفید رنگ به فلز سرب تبدیل شود و اسید سولفوریک دوباره تولید شود. عملیات شارژ و دشارژ هر سلول را میتوان بارها تکرار کرد.
نکته: همانطور که قبلاً هم گفته شد، همیشه تا کاتد باتری به طور کامل خورده نشود، از باتری میتوان جریان کشید.
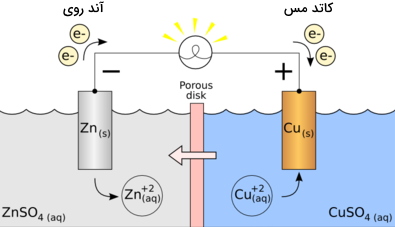
سلولهای الکترو شیمیایی(Galvanic cell):

یک سلول گالوانی یا ولتایی (ولتاییک)، نوعی از سلولهای الکتروشیمیایی به شمار میآید که به منظور تامین جریان الکتریکی از آن استفاده میشود. این تامین جریان از طریق انتقال الکترونها به کمک واکنشهای اکسایش و کاهش (ردوکس) روی میدهد. یک سلول گالوانی نمونهای از ایده کنترل و بکارگیری انرژی به کمک واکنشهایی ساده بین عناصر مشخص است.
اجزای سلول ولتایی
در ادامه، اجزای سلول گالوانی (ولتایی) آورده شده است.
- آند: اکسایش در این الکترود انجام میگیرد.
- کاتد: کاهش در این الکترود رخ میدهد.
- پل نمکی: شامل الکترولیت و برای تکمیل مدار در یک سلول گالوانی مورد نیاز است.
- نیمسلولها: به کمک نیمسلولها، واکنشهای اکسایش و کاهش به دو بخش مختلف تقسیم و از یکدیگر جدا میشوند.
- مدار خارجی: سبب جریان الکترونها بین الکترودها میشود.
سلولهای گالوانی (ولتایی)سلولهای گالوانی به دو دسته تقسیم میشوند:
الف) سلولهای گالوانی نوع اوّل: تمام باتریهای خشک و سلولهای سوختی (که در ادامهی این مبحث آمده است) از جمله سلولهای گالوانی نوع اوّل هستند، زیرا با تمام شدن واکنش دهندههای آن (یعنی خورده شدن قطب منفی در باتریهای خشک و تمام شدن گاز در سلولهای سوختی) دیگر نمیتوان از آنها استفاده کرد.
ب) سلولهای گالوانی نوع دوم: مانند سلولهای سوختی که در این سلولها از واکنش دادن دو گاز در داخل محفظهای بسته، میتوان انرژی الکتریکی بدست آورد. این دو گاز میتوانند اکسیژن و هیدروژن و یا گاز شهری (متان=CH۴) باشد. کاربرد سلولهای سوختی در فضاپیماها و… میباشد.
نکته: باتری ۹V نیز نوعی باتری است که به صورت قابل شارژ و غیر قابل شارژ وجود دارد. در شکل زیر یک باتری ۹V را مشاهده میکنید:
سلولهای الکترولیتی(Electrolytic cell):
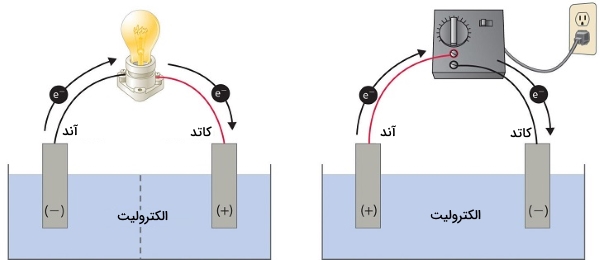
این سلولها شامل دو الکترود کاتد و آند میباشد که در درون محلول الکترولیتی قرار دارند.
سؤال: محلول الکترولیت چیست؟
محلول الکترولیت از دو قسمت مجزا تشکیل شده است که این دو قسمت در درون دو ظرف پلاستیکی قرار دارند که در داخل هرکدام از این ظروف ترکیب آب، یک الکترود فلزی و همان فلز به صورت یون وجود دارد (وقتی یک فلز به صورت یون در میآید که با اسید واکنش بدهد)؛ وقتی که این دو الکترود را با یک پل نمکی به هم متصل کنیم، به شرط آنکه در درون هریک از یونهای فلزی، یک قطعه فلز از همان فلزی که به صورت یون است قرار دهیم، در این صورت اگر وسیلهی الکتریکی مناسبی بین این دو قطعه فلز قرار دهیم، جریان از آن عبور میکند.
نکته: پل نمکی از یک کاغذ صافی آغشته شده به KCL [پتاسیم کلرید]و… ساخته میشود که برای راحت جابجا شدن بارهای الکتریکی بین دو محلول الکترولیتی استفاده میشود.
نکته: کاربرد سلولهای الکترولیتی چندان زیاد نیست، ولی در سطوح بعدی روشی را خواهیم گفت که بتوان با این روش اسید فیبر مدار چاپی (که در سطح ۵ معرفی شده است) را برای بارها مورد استفاده قرار داد و مسهای حل شده در اسید را از اسید پس گرفت.
نکته: آب را به عناصر سازنده اش تجزیه کنید:
اگر دو الکترود را (مثلاً دو میلهی گرافیتی که این دو میله را میتوانید از باتری قلمی بدست بیاورید) در یک ظرف آب قرار دهید، وقتی برق مستقیمی به الکترودها اعمال بشود که ولتاژ بالایی با جریان مناسب داشته باشد (از ۲۰V به بالا)، در این صورت در اطراف الکترود منفی (میلهی گرافیتی متصل شده به قطب منفی) هیدروژن با گرفتن الکترون به گاز تبدیل میشود و در اطراف الکترود مثبت اکسیژن با گرفتن پروتون به گاز تبدیل میشود. باید این دو الکترود غیر فلزی و رسانا باشند، چون وقتی برق مستقیم به این الکترودها اعمال شود، در این صورت در پیرامون الکترودها محیط اسیدی و بازی به وجود میآید که باعث میشود الکترودها خورده شوند. پس از مدتی آب موجود در ظرف خاصیت قلیایی (بازی) پیدا میکند.
نکته: سلولهای الکترولیتی در یکی از گرایشهای رشتهی شیمی به نام الکترو شیمی، بررسی میشوند که قصد وارد شدن بیش از حد به این شاخه را نداریم.
نکته: همهی سلولهای گالوانی برق مستقیم (DC=Direct Current) تولید میکنند.